
廣東省藥品監(jiān)督管理局辦公室關于印發(fā)醫(yī)用口罩,、醫(yī)用防護服等疫情防控急需用器械應急審批申辦指引的通知
粵藥監(jiān)辦許〔2020〕90號
各地級以上市市場監(jiān)督管理局:
為進一步做好防控新型冠狀病毒感染的肺炎疫情所需醫(yī)療器械應急審批工作,,結合《廣東省藥品監(jiān)督管理局辦公室關于調整一級響應期間對醫(yī)用口罩等防控急需用器械實施特殊管理的通知》(粵藥監(jiān)辦許〔2020〕78號,以下簡稱78號文),,我局組織編寫了《醫(yī)用口罩,、醫(yī)用防護服等疫情防控急需用器械應急審批申辦指引》(見附件)。現(xiàn)印發(fā)你們,,并提出以下工作要求,,請一并貫徹落實。
一,、要積極做好應急審批申辦指引的宣貫,,有序引導企業(yè)申請應急審批。各市出具的應急審批情況說明品種僅針對醫(yī)用口罩,、醫(yī)用防護服,、紅外體溫測量設備,其他防控疫情所需醫(yī)療器械的應急審批情況說明,,應由省級以上聯(lián)防聯(lián)控物資保障組或科技攻關組出具意見,。
二、全面梳理應急備案信息,,根據(jù)78號文要求,,對3月1日前完成的應急備案信息應在3月7日晚上24點前(以上報郵件發(fā)送時間為準)完成上報,未能按時上報的產(chǎn)品,,視為未獲得應急備案,,請各市局指導企業(yè)按應急審批申辦指引申報。省局將依據(jù)應急備案企業(yè)品種信息開展專項檢查,。
三、加強對應急備案企業(yè)的監(jiān)管,,對不符合備案質量標準的產(chǎn)品,,應要求企業(yè)予以整改并召回已上市的產(chǎn)品;情節(jié)嚴重的,,應予以收回并注銷應急備案憑證,,同時上報省藥監(jiān)局。
四,、3月1日起,,除78號文明確可在應急備案憑證調整的內容外,其他內容的變更應按應急審批首次注冊程序辦理,。
附件:醫(yī)用口罩,、醫(yī)用防護服等疫情防控急需用器械應急審批申辦指引
廣東省藥品監(jiān)督管理局辦公室
2020年3月6日
附件
醫(yī)用口罩、醫(yī)用防護服等疫情防控急需用器械應急審批申辦指引
根據(jù)《廣東省防控新型冠狀病毒感染的肺炎疫情所需藥品醫(yī)療器械行政許可應急審批程序》,對已有同類產(chǎn)品上市,,但產(chǎn)品供應不能滿足防控疫情應急處理需要的醫(yī)療器械,,制定以下應急審批指引。
一,、對于申請應急審批首次注冊的醫(yī)療器械,,申請人應提供省級以上聯(lián)防聯(lián)控物資保障組或科技攻關組出具的意見,對醫(yī)用口罩,、醫(yī)用防護服和紅外體溫測量設備可提供市級以上聯(lián)防聯(lián)控物資保障部門出具的應急審批情況說明(見附件1),。
二、申請人可憑市工信部門或市場局出具的說明,,向有資質的醫(yī)療器械檢驗機構(見附件2)申請全性能的應急檢驗,。申請檢驗時,應向檢驗機構提供樣品,、產(chǎn)品技術要求和說明書,。涉及“無菌”檢驗項目的,可在審評環(huán)節(jié)補交,;涉及相關國家標準或行業(yè)標準中的生物性能要求,,可基于原材料的生物相容性試驗報告開展評價。
三,、申請人提出應急注冊申請的,,向省藥品監(jiān)督管理局提交注冊申報資料,具體要求見第二類醫(yī)療器械注冊證核發(fā)辦事指南(http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212440172015007),。醫(yī)療器械注冊申請表中產(chǎn)品名稱填寫時應使用括號備注“疫情應急產(chǎn)品”,,如:醫(yī)用防護口罩(疫情應急產(chǎn)品)。申請資料第2項證明性文件中應同時提供關于應急審批的情況說明,。
四,、申請人應在注冊受理后2個工作日內提交注冊質量管理體系核查申請,具體要求見辦事指南(http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212442072032000),。逾期未提交的,,應急注冊申請予以退回辦結。申請人應在提交申請后5個工作日內接受現(xiàn)場檢查,,否則應急注冊申請予以退回辦結,。
生產(chǎn)非無菌醫(yī)用口罩、醫(yī)用防護服的,,應達到清潔生產(chǎn)環(huán)境要求(參見附件3),。生產(chǎn)無菌醫(yī)用口罩的,應具備不低于30萬級生產(chǎn)環(huán)境潔凈度級別,,并提供相應的檢測報告,。生產(chǎn)采用輻照滅菌方式的無菌醫(yī)用防護服的,,應達到不低于清潔生產(chǎn)環(huán)境要求。申請人自身不具備檢驗能力的,,可以委托具有同類產(chǎn)品檢驗能力的第三方檢驗機構或醫(yī)療器械生產(chǎn)企業(yè)開展,。體系核查申請時應提供上述相應證明材料,并在申請前開展自查,。
五,、申請人應建立質量管理體系并保持有效運行,配備相應生產(chǎn)設備,、人員,、場地,具備生產(chǎn)管理和質量控制能力,,保留相應記錄,,具體參見原國家食品藥品監(jiān)管總局2014年發(fā)布的《醫(yī)療器械生產(chǎn)質量管理規(guī)范》(http://www.nmpa.gov.cn/WS04/CL2138/299995.html)。審評部門自收到材料之日起在2個工作日內組織開展現(xiàn)場檢查,。檢查后涉及整改的,,申請人應在10個工作日內提交整改報告,逾期未提交的,,應急注冊申請予以退回辦結,。注冊質量管理體系核查未通過的,應急注冊申請不予批準,。
六,、審評部門在組織現(xiàn)場檢查后5個工作日內完成技術審評。審評過程需要申請人補充資料的,,應當15個工作日內補充,。逾期未補充的,應急注冊申請予以退回辦結,。審評部門在收到補充資料后3個工作日內完成最終技術審評,。
七、審批部門在技術審評和質量管理體系核查均完成后3個工作日內完成行政審批,。
申請人提出應急審批申請的,,應提前做好申報前的準備,配合做好應急審批各環(huán)節(jié)辦理,,因申請人無法按要求履行的,建議按照醫(yī)療器械注冊常規(guī)程序申報,。申請人在申報過程中遇有問題的,,可發(fā)電子郵件至[email protected]咨詢,或可致電020-37886014咨詢。
附件:
1. 關于XXXX企業(yè)申請第二類醫(yī)療器械應急審批的情況說明(參考模板)
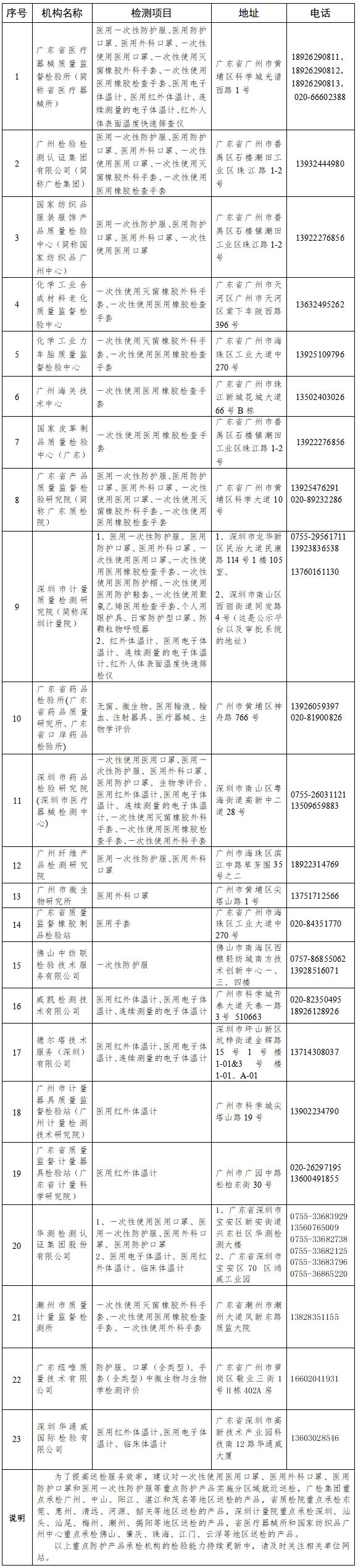
2.省內醫(yī)療器械防護用品檢驗檢測機構名錄
3.應急情況下建立受控清潔環(huán)境的指導意見
附件1

附件2
省內醫(yī)療器械防護用品檢驗檢測機構名錄
附件3
應急情況下建立受控清潔環(huán)境的指導意見
一,、控制廠房空氣清潔度,。可在原有廠房空調系統(tǒng)加裝濾材,不具備條件的可配備一定數(shù)量的大功率凈化器,;同時應當增加通風,,保持生產(chǎn)車間內空氣合理循環(huán)流通和清潔,盡可能保持空氣正壓,。
二,、生產(chǎn)前對車間環(huán)境、設備進行清潔消毒,。
三,、凡進出清潔車間的人員,都必須按下列程序進行:
進:換鞋→洗手→戴工作帽→穿工作服→緩沖區(qū)→清潔車間→手消毒
出:清潔車間→脫工作服→換鞋
四,、每個班次裸手操作接觸產(chǎn)品的員工應定時進行手消毒,。
五、凡在清潔區(qū)域內的一切門窗要緊閉,,進出人員做到隨手關門,,以免空氣的對流。
六,、采用反向安裝方式加裝無臭氧紫外燈,,工作時間保持持續(xù)消毒。若無法反向安裝,,應在非工作時間或工作前適當時間定期消毒并做記錄(每次消毒的時間不少于30分鐘),。
七、控制物料和產(chǎn)品進出可能對環(huán)境造成的污染,。原料應當脫掉外包裝并進行必要的清潔后再進入車間,。有條件的可設置緩沖區(qū),可以更好地起到減少污染的作用,。
剩余或散裝的物資及時采取防塵措施,,以免污染。對已確認被污染的物資,,另行堆放,、標識,處理,。
八,、每個班次工作完畢后,操作者清除內廢物和擦拭工作臺,、設備外表面,。
九、每天由清潔員擦拭地面,、門窗和積塵處,。
十,、至少每月全面擦拭工作場所的密封窗、照明,、風口等除塵和消毒,。
十一、有條件的可對成品的初始污染及生產(chǎn)車間的表面微生物等進行適當頻次的檢測或監(jiān)測,;無條件的可請具備條件的企業(yè)或機構協(xié)助進行定期監(jiān)測,,經(jīng)評估有風險的,應采取必要的措施進行管理與控制,。